




| O projekcie | Do pobrania | Publikacje | Wykonawcy | Osiągnięcia |
| Aktualności |
|
2.12.2015 - Nasz najnowszy artykuł o symulacji obrazowania Time-of-Flight oraz Phase Contrast Angiography jest już dostępny on-line. Zachęcamy do lektury.
30.11.2015 - W zakładce Do pobrania dodaliśmy odnośnik do projektu dla środowiska Xcode z naszą implementacją algorytmu do symulacji rozrostu drzew naczyń krwionośnych. Zachęcamy do pobierania :-). 6.10.2015 - Udostępniamy dwa nowe syntetyczne modele rozgałęzienia tętnicy szyjnej (zobacz). 15.08.2015 - Rozpoczynamy realizację nowego projektu nt. symulacji rezonansu magnetycznego. Tym razem zajmiemy się modelowaniem perfuzji nerek. Wkrótce pojawi się więcej informacji. |
| Polecamy |




|
| Licznik wizyt |
|
Liczba odsłon strony od 1.03.2015 r. |
Symulacja przepływu
Przepływ krwi
Zgodnie z założeniami projektu, symulacja przepływu krwi przez naczynia została zrealizowana za pomocą oprogramowania Comsol Multiphysics. Podstawowym zestawem narzędziowym do symulacji przepływu w programie Comosol jest biblioteka Fluid Flow. W bibliotece tej symulacja przepływu laminarnego odbywa się z zastosowaniem numerycznego rozwiązania równań Naviera-Stokes’a. Model laminarny stanowi wystarczająco dobre przybliżenie rzeczywistego zjawiska przepływu dla naczyń dużych oraz średnich. W przypadku przewężeń, bifurkacji, a także krętych struktur charakterystycznych np. dla zmian nowotworowych, zachowanie cieczy staje się bardziej chaotyczne i przepływ ma lokalnie charakter turbulentny. Wówczas do rozwiązania zagadnienia symulacji stosują się równania modelu RANS (ang. Reynolds-averaged Navier-Stokes).
Symulacja przepływu w programie Comsol wymaga zdefiniowania modelu geometrycznego naczynia oraz różnicy ciśnień pomiędzy jego otworem wlotowym i wylotowym (lub zbiorem otworów wylotowych w przypadku układu naczyń). W szeregu wykonanych symulacji zadbano o to, aby uzyskiwane wartości prędkości przepływu mieściły się w zakresie fizjologicznym. Prędkości te dla największych naczyń dochodzą do poziomu 100 cm/s. W przykładzie zaprezentowanym na rysunku poniżej ciśnienie wejściowe i na wyjściach układu ustalono odpowiednio na poziomie 11168 Pa i 11148 Pa. Maksymalna wartość bezwzględna dla wyznaczonych prędkości przepływu wynosi w tym przypadku 8 cm/s.
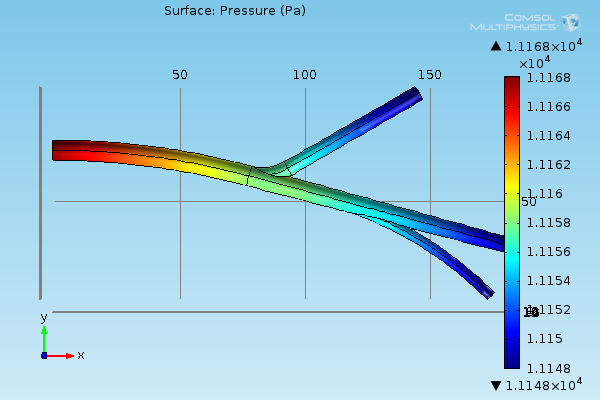
Rozkład ciśnienia na ścianach naczyń wyznaczony w symulacji przepływu cieczy.
Transport magnetyzacji
Kwestią o zasadniczym znaczeniu dla symulacji angiografii rezonansu magnetycznego jest sposób wykorzystania informacji o prędkościach przepływu cieczy, a więc i będących źródłem sygnału pomiarowego protonów wodoru zawartych we krwi. Zagadnienie to określa się w literaturze jako transport magnetyzacji. Wektory prędkości przepływu wyznaczane są lokalnie w każdym elemencie dyskretnej siatki (ang. mesh) tworzącej trójwymiarową bryłę naczynia. Każdy węzeł stanowi ułamek objętości całego naczynia i jako taki reprezentuje określoną porcję cieczy. Porcji tej można byłoby zatem przypisać wektor magnetyzacji, którego chwilowy stan byłby określony za pomocą równań modelujących zjawisko jądrowego rezonansu magnetycznego (ang. nuclear magnetic resonance, NMR). Jednakże położenie węzłów siatki nie zmienia się w czasie. Tymczasem dyskretyzacja przestrzeni oraz czasu symulacji może prowadzić do problemu tzw. dyfuzji cyfrowej. Zjawisko to dobrze ilustruje kolejny rysunek, na którym pokazano ruch pewnej porcji cieczy w trzech kolejnych krokach czasowych o odstępach Δt.

Ilustracja zjawiska dyfuzji cyfrowej.
Rzeczywiste przemieszczenie cieczy następuje z położenia x1 do x2, co widać w górnej części rysunku. W dolnym rzędzie pokazano z kolei trzy sąsiadujące ze sobą węzły siatki. Ponieważ tylko fragment cieczy z węzła 1 znalazł się po czasie Δt (krok 2) w węźle 2, konieczne staje się uśrednienie dla węzłów 1 i 2 wektora magnetyzacji początkowo skojarzonego z węzłem 1. W kroku 3, ponownie tylko ułamek objętości cieczy z węzła 1 przepłynie do węzła 2 i jednocześnie pewna część cieczy z węzła 2 przedostanie się do węzła 3. W efekcie uśrednienie wektora magnetyzacji obejmuje trzy sąsiednie węzły, chociaż całość magnetyzacji powinna znaleźć się jedynie w węźle środkowym.
Trajektorie cząstek
Dlatego w zaprojektowanym symulatorze problem transportu magnetyzacji rozwiązano w oparciu o tzw. trajektorie cząstek. Do wyznaczenia trajektorii wykorzystuje się specjalny moduł programu Comsol – Particle Tracing for Fluid Flow. Działanie tego modułu wymaga w pierwszej kolejności przeprowadzenia standardowej symulacji przepływu cieczy. Następnie na wejściu naczynia umieszcza się zadaną liczbę cząstek, które równomiernie wypełniają jego przekrój poprzeczny. Cząstki przepływają przez naczynie zgodnie z kierunkiem przepływu cieczy, przy czym ich chwilową prędkość definiuje pole wektorowe prędkości wyznaczone podczas wstępnej symulacji przepływu. Położenia cząstek w naczyniu w kolejnych krokach czasowych Δt wyznaczają wiązkę trajektorii, a ta z kolei stanowi zbiór danych wejściowych dla symulatora angiografii rezonansu magnetycznego. Poniżej przedstawiono przykładowe wiązki trajektorii otrzymane dla przedstawionego wcześniej modelu naczyń.
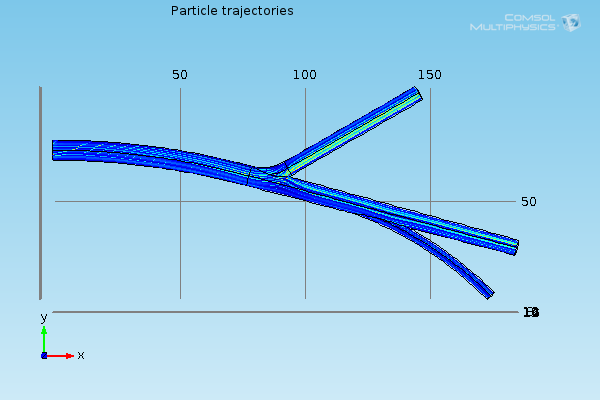
Przykładowe trajektorie cząstek.
Następnie za pomocą opracowanej metody naczynie krwionośne wypełniane jest dodatkowymi cząstkami na całej długości trajektorii. Krok ten jest niezbędny, gdyż to właśnie z cząstkami skojarzone są wektory magnetyzacji reprezentujące pakiety spinów dających sygnał. Procedura wypełniania trajektorii cząstkami musi uwzględniać takie czynniki jak zadana objętość porcji cieczy poruszającej się wraz z cząstką, czy prędkość jej przepływu przez naczynie. Ponadto, algorytm wypełniania po uruchomieniu symulacji obrazowania odpowiedzialny jest za dodawanie na wejściu układu naczyń nowych cząstek w miejsce tych, które z tego układu wypłynęły. Bardzo ważną funkcją programu jest także możliwość interpolacji położenia cząstki na trajektorii w dowolnej chwili czasowej. Dzięki temu, symulacja rezonansu magnetycznego może być wykonywana z dowolną rozdzielczością czasową. Zobacz też film poglądowy ilustrujący działanie wykonanej biblioteki do wypełniania trajektorii dodatkowymi cząstkami.